Bedre prognose med god ernæringsstatus.
Kreftbehandlingen blir stadig mer avansert, og vi går i retning av større grad av individtilpasset kreftbehandling. Men oppi all medisinsk nyvinning er det lett å glemme et av våre grunnleggende behov. Vi må ha mat for å overleve og for å fungere optimalt. Og dette blir desto viktigere under aktiv kreftbehandling.
Mange kreftpasienter er underernært
Det er anslått at opp til 85 % av alle kreftpasienter blir underernærte på et tidspunkt i løpet av behandlingsforløpet [1]. Risiko for underernæring avhenger blant annet av kreftdiagnose, alvorlighetsgrad av sykdommen, samt type og varighet av behandlingen. Vekttap forekommer for eksempel hyppigere hos pasienter med kreftsykdom i fordøyelseskanalen enn hos pasienter med kreft i bryst og prostata [2]. Hos pasienter med langtkommen kreftsykdom er vekttap vanlig uavhengig av diagnose [2]
Les også:Kosthold ved kreft
Kreftsykdom - en påkjenning for kroppen
Optimalt næringsinntak spiller en viktig rolle under aktiv behandling. Kroppen trenger tilstrekkelig med energi, vitaminer og mineraler for å opprettholde vitale funksjoner. I tillegg vil man ved kreftsykdom kunne ha et økt behov for energi og/eller andre næringsstoffer, noe som kan skyldes kreftsykdommen i seg selv eller dens behandling.
Kreftsykdom kan føre til redusert appetitt, tidlig metthetsfølelse og metabolske forandringer [3]. Cancer kakeksi er et multifaktorielt syndrom som karakteriseres av et kronisk, progredierende og ufrivillig vekttap som ikke fullt ut lar seg reversere av konvensjonell ernæringsbehandling [3].
Ved cancer kakeksi kan man altså spise nok kalorier, og likevel gå ned i vekt fordi kroppen ikke klarer å nyttiggjøre seg av all næringen den får tilført. To faktorer står sentralt i utviklingen av cancer kakeksi; redusert næringsstoffinntak og metabolske forandringer forårsaket av systemiske proinflammatoriske prosesser [3]. Metabolske forandringer forbundet med cancer kakeksi inkluderer blant annet insulin resistens, økt lipolyse, økt eller uendret lipidoksidasjon og økt proteinturnover [3]. Disse metabolske forandringene kan gi utslag i tap av kroppsfett og protein, og således være kritisk for pasientens ernæringsstatus.
Behandling av kreft varierer med kreftsykdom, men innebærer som oftest kirurgi, cellegift, stråleterapi, hormonbehandling og/eller annen medikamentell behandling. Kreftbehandlingen har til hensikt å drepe kreftcellene. Men dessverre kommer man sjelden utenom å skade de friske cellene i prosessen. Dette kan forårsake mange bivirkninger, deriblant redusert appetitt, sår og tørr munn, endret smak og lukt, kvalme, oppkast, forstoppelse, diare og slapphet [4]. Alle disse symptomene vil kunne påvirke næringsinntaket, og dermed pasientens ernæringsstatus.
Kombinasjonen av økt energibehov og tilstedeværelse av ernæringsrelaterte bivirkninger gjør at mange pasienter er i risiko for å utvikle underernæring under kreftbehandlingen.
Underernæring – når kroppen tærer på egne reserver
Underernæring defineres av Helsedirektoratet som en tilstand der mangel på energi, protein og/eller andre næringsstoffer fører til en ugunstig endring i kroppssammensetning og funksjon, samt klinisk utfall [2]. Underernæring omfattes av de internasjonale diagnosekodene ICD-10 E.46 (uspesifisert underernæring), E.44 (moderat underernæring) og E.43 (alvorlig underernæring) [2]. De diagnostiske kriteriene innebærer en vurdering av ufrivillig vekttap, kroppsmasseindeks (KMI) og matinntak den siste perioden.
Klinisk er det viktig å skille mellom sykdomsrelatert vekttap og frivillig vekttap som oppstår som følge av fordelaktige endringer i kosthold og fysisk aktivitet. Ved frivillig vekttap tæres det først og fremst på fettlagrene, mens tapet av protein er mindre uttalt. Ved sykdomsrelatert vekttap kan derimot proteintapet være stort. Dette er kritisk ettersom kroppen ikke har noe lager av protein. Kroppen må derfor tære på de livsviktige proteinene som hver og en har nøkkelfunksjoner i kroppen [5].
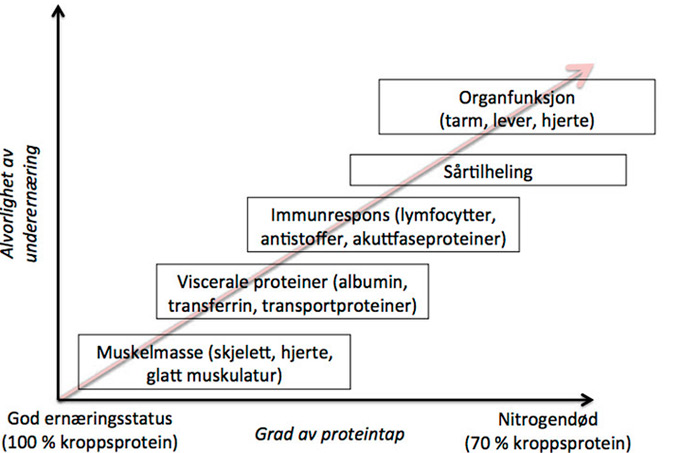
Figur 1 illustrerer hvordan tap av protein er knyttet opp mot alvorlighetsgrad av underernæring. Ved begynnende vekttap tærer kroppen først og fremst på muskelprotein, inklusive protein fra skjelett, hjerte og glatt muskulatur. Muskeltap etterfølges av tap av viscerale proteiner som albumin, transferrin og transportproteiner. Videre protein-energi underernæring fører til svekket immunforsvar, noe som kommer til uttrykk i form av redusert antall lymfocytter, antistoffer og akuttfaseproteiner. Klinisk gir dette utslag i redusert evne til å reparere sår, noe som vil være spesielt kritisk for den kirurgiske pasienten. I siste fase tærer kroppen på egne organer. Dette fører til svekket organfunksjon, og gjør kroppen ute av stand til å håndtere den minste form for biologisk stress. Nitrogendød inntreffer når 30 % av kroppsnitrogen er tapt. Denne tilstanden er ikke forenelig med liv [5].
Les også: Kosthold ved underernæring
Figur 1
For å redusere tap av protein til et minimum er det ikke anbefalt å gå ned i vekt under aktiv behandling. Dette er dessverre ikke like godt etablert kunnskap. Verken blant helsepersonell eller pasienten selv. Ofte kan pasientene se det som fordelaktig å tape noen ekstra kilo i forbindelse med behandlingen, de kiloene man uansett anså som overflødig før man ble syk. Men også overvektige pasienter kan være i ernæringsmessig risiko, og vil kunne ha negative konsekvenser av å gå ned i vekt.
God ernæringsstatus av betydning for livskvalitet og prognose
Nok og riktig mat er viktig for kreftpasientens ve og vel. Ikke bare er underernæring assosiert med dårligere funksjonell kapasitet og styrke [6, 7], men det er også assosiert med redusert livskvalitet [8-12]. Underernærte kreftpasienter tilbringer flere døgn på sykehus og blir oftere reinnlagt etter utskrivelse [13, 14]. I tillegg har de ofte nedsatt immunforsvar, noe som gjør de mer mottakelig for å få infeksjoner [15].
Underernæring ser også ut til å påvirke behandlingen. Underernærte kreftpasienter mottar i snitt lavere doser kreftmedisin [8], opplever flere dose-begrensende toksiske bivirkninger [8, 16-18] og har lavere behandlingsrespons [8, 19]. Dette er urovekkende, tatt i betraktning hvor viktig det er å fullføre behandlingen.
Mye tyder også på at underernærte kreftpasienter lever kortere enn velernærte [8, 13, 14, 20-22]. I en prospektiv kohortstudie av Martin og medarbeidere [23] ønsket man å undersøke den prognostiske betydningen av vekttap og muskelstatus blant 1473 pasienter med kreft i lunge og fordøyelseskanalen. Ikke overaskende viste vekttap og muskelstatus seg å være uavhengige prognostiske faktorer for overlevelse. En modell som inkluderte vekttap, lumbal skjelettmuskelindeks og muskelsvekkelse viste seg å predikere overlevelse i større grad enn en modell basert på de veletablerte prognostiske variablene diagnose, stadium, alder og funksjonsstatus. Vekttap og muskelstatus var forbundet med redusert overlevelse uavhengig av KMI.
Les også: Kosthold ved dårlig appetitt
Ernæringsscreening sikrer behandling av rett pasient til rett tid
Ernæringsscreening er en undersøkelsesmetode der man går systematisk til verks for å lete etter pasienter med redusert ernæringsstatus [2]. Screening gjør det mulig å identifisere pasienter i ernæringsmessig risiko ved et tidlig stadium, slik at tiltak kan igangsettes før underernæring har oppstått. Ernæringsscreening vil således kunne ha stor innvirkning for pasientens behandlingsforløp og prognose.
I følge Helsedirektoratet skal alle pasienter som møter helse- og omsorgstjenesten vurderes for ernæringsmessig risiko som en del av et helhetlig undersøkelses- og behandlingstilbud [24]. Personer i ernæringsmessig risiko skal videre følges opp med en individuell ernæringsplan som tar hensyn til pasientens ernæringsstatus, behov og matinntak etterfulgt av tiltak som igangsettes [24]. ESPEN guidelines anbefaler at alle kreftpasienter screenes for ernæringsmessig risiko jevnlig fra diagnosetidspunktet for å sikre at ernæringsbehandlingen igangsettes så fort tidlige tegn til underernæring har oppstått [3]. Studier viser at tidlig oppstart av ernæringsbehandlingen øker sjansene for å oppnå et vellykket behandlingsresultat [25]. Desto lenger man venter med å starte opp behandlingen, desto vanskeligere er det å korrigere pasientens ernæringsstatus.
Gode rutiner for screening på sykehus vil bidra til at rett pasient henvises til rett tid. Ernæringsscreening vil også bidra til effektiv bruk av kliniske ernæringsfysiologers tid, en yrkesgruppe som ofte er en begrenset ressurs på sykehuset [25].
Ernæringsbehandling som en integrert del av kreftbehandlingen
Det er på høy tid at ernæringsscreening og behandling vies økt oppmerksomhet i behandlingen av kreftpasienter, og anerkjennes som en sentral del av moderne kreftmedisin.
Som Alessandro Laviano, Professor ved Sapienza University i Roma og foredragsholder på årets KEFF-konferanse poengterte så fint, «Vi må ta hånd om hele pasienten, ikke bare pasientens kreftceller». Dette kan potensielt ha stor innvirkning for pasientens livskvalitet, behandlingsrespons og prognose.
Artikkelen er hentet fra Norsk tidsskrift for ernæring.